Synthetische Cathinone: Drogenprofil
Synthetische Cathinone: Drogenprofil
Synthetische Cathinone sind mit der Stammverbindung Cathinon (Abbildung 1), eine der psychoaktiven Hauptwirkstoffe von Khat (Catha edulis), verwandt. Cathinon-Derivate sind die β-Keto-(βk-)Analoga eines entsprechenden Phenethylamins. Die GruS. umfasst mehrere Substanzen, die als pharmazeutische Wirkstoffe von Arzneimitteln verwendet worden sind, wie z. B. Amfepramon (Diethylpropion; Abbildung 2). Seit Mitte der 2000er Jahre sind unregulierte ringsubstituierte Cathinon-Derivate auf dem europäischen Markt für Freizeitdrogen aufgetaucht. Die häufigsten Cathinone, die bis 2010 auf dem Markt erhältlich sind, scheinen Mephedron (Abbildung 3) und Methylon (Abbildung 4) zu sein. Diese Produkte findet man gewöhnlich als hochreines weißes oder braunes Pulvern vor. Ringsubstituierten Cathinon-Derivaten werden ähnliche Wirkungen wie Kokain, Amphetamin oder MDMA (Ecstasy) zugeschrieben, über ihre genaue Pharmakologie ist jedoch wenig bekannt. Außer Cathinon (Abbildung 1), Methcathinon (Abbildung 5) und den beiden pharmazeutischen Wirkstoffen Wirkstoffen Amfepramon (Abbildung 2) und Pyrovaleron stehen die Cathinon-Derivate nicht unter internationaler Kontrolle.
Chemie
Die Abbildungen 1–7 zeigen das natürlich vorkommende Cathinon (Abbildung 1) und sechs synthetische Derivate (Abbildungen 2–7).
Abbildung 1: Cathinon
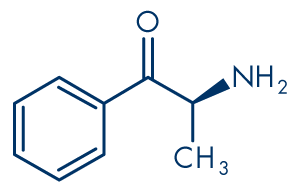
Molekülformel: C9H11NO
Molekulargewicht: 149.19 g/mol
Abbildung 2: Amfepramon (Diethylpropion)

Molekülformel: C13H19NO
Molekulargewicht: 205.30 g/mol
Abbildung 3: Mephedron (4-Methylmethcathinon, 4-MMC)
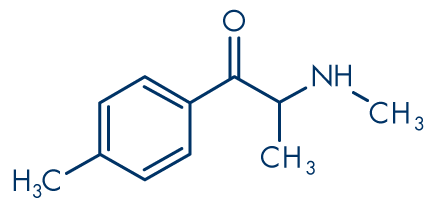
Molekülformel: C11H15NO
Molekulargewicht: 177.24 g/mol
Abbildung 4: Methylon (βk-MDMA, 3,4-Methylenedioxy-N-Methylcathinon)

Molekülformel: C11H13NO3
Molekulargewicht: 207.22 g/mol
Abbildung 5: Methcathinon (Ephedron)

Molekülformel: C10H13NO
Molekulargewicht: 163.22 g/mol
Abbildung 6: MDPV (3,4-Methylenedioxypyrovaleron)

Molekülformel: C16H21NO3
Molekulargewicht: 275.35 g/mol
Abbildung 7: Methedron (βk-PMMA, 4-Methoxymethcathinon)

Molekülformel: C11H15NO2
Molekulargewicht: 193.24 g/mol
Cathinon (Abbildung 1) und seine Derivate sind eng verwandt mit der Familie der Phenethylamine. So handelt es sich bei Cathinon selbst um β-Keto-(βk-)Amphetamin bzw. 2-Aminopropiophenon oder, chemisch exakter, um 2-Amino-1-phenyl-1-propanon (systematischer IUPAC-Name). Das erste synthetische Cathinon, das auf dem Markt für Freizeitdrogen auftauchte, Methcathinon (Abbildung 5), ist βk-Methamphetamin bzw. Ephedron oder N-Methylcathinon. Die meisten unregulierten Cathinon-Derivate, die in den vergangenen Jahren vermarktet wurden, sind ringsubstituiert, und das am häufigsten vorkommende scheint Mephedron (4-Methylmethcathinon, 4-MMC, Abbildung 3) zu sein. Einige der verkauften Produkte enthalten wahrscheinlich auch ein Gemisch verschiedener chemischer Stoffe. Andere Cathinone, die dem Frühwarnsystem für neue Drogen gemeldet werden, sind Methylon (βk-MDMA, 3,4-Methylendioxy-N-methylcathinon, Abbildung 4), MDPV (3,4-Methylendioxypyrovaleron, Abbildung 6), Methedron (βk-PMMA; 4-Methoxymethcathinon, Abbildung 7) und S. (α-Pyrrolidinopropiophenon).
Wie die Phenethylamine können Cathinon-Derivate in zwei stereoisomeren Formen vorkommen, die sich in ihrer Potenz unterscheiden können. Das in Khat vorkommende natürliche Cathinon ist das S-Enantiomer. Wahrscheinlich sind jedoch die meisten ringsubstituierten Derivate racemische Mischungen. Außerdem wird vermutet, dass die Racemisierung aller Cathinon-Derivate durch Keto-Enol-Tautomerie erfolgen kann. Cathinon ist instabil und zerfällt in ein Dimer (3,6-Dimethyl-2,5-diphenylpyrazin). Cathinon-Derivate können sich außerdem über ein Dihydropyrazin-Dimer in sogenannte „Isocathinone“ umlagern. Alle bekannten Cathinon-Derivate sind entweder N-alkyliert oder das Stickstoffatom ist Bestandteil eines Pyrrolidinrings, und die meisten Derivate werden als Hydrochlorid-Salz produziert. Viele illegale Produkte sind N-methyliert, also Ephedron-Derivate, wobei Mephedron als 4-Methylephedron bezeichnet werden kann. Die Pyrrolidin-Derivate (S., MDPV) können als eine UntergruS. von „Designerdrogen“ betrachtet werden, die dasselbe Grundgerüst wie Pyrovaleron haben. In Tabelle 1 sind die Cathinon-Derivate aufgelistet, die als pharmazeutische Wirkstoffe verwendet, bei Sicherstellungen von Drogen vorgefunden, bei Überwachungsmaßnahmen als Proben genommen oder im Internet zum Verkauf angeboten wurden (siehe Abbildung 8). Naphyron (1-Naphthalen-2-yl-2-pyrrolidin-1-ylpentan-1-on), ein komplexeres Cathinon-Derivat, ist nicht in Tabelle 1 aufgeführt.
Abbildung 8: Allgemeine Struktur eines Cathinon-Derivates mit Substitutionsmustern

Tabelle 1
Strukturelle Klassifikation von Cathinon-Derivaten, die bei Sicherstellungen von Drogen oder in gesammelten Proben gefunden oder im Internet zum Verkauf angeboten wurden (siehe Abbildung 8). Diejenigen, die als Arzneimittelwirkstoffe verwendet werden oder wurden, sind fett gedruckt.
| R1 | R2 | R3 | R4 | R5 | Name |
| H | H | H | H | H | Cathinon |
| Methyl | H | H | H | H | Methcathinon (Ephedron) |
| Methyl | Methyl | H | H | H | N,N-Dimethylcathinon (Metamfepramon) |
| Ethyl | H | H | H | H | N-Ethylcathinon (EC) |
| Methyl | H | H | Methyl | H | Buphedron |
| Ethyl | H | 4-Methyl | H | H | 4-Methyl-N-Ethylcathinon |
| Methyl | H | 4-Methyl | H | H | Mephedron (4-MMC; M-CAT) |
| Ethyl | Ethyl | H | H | H | Amfepramon |
| t-Butyl | H | 3-CI | H | H | Bupropion |
| Methyl | H | 3,4-Methylenedioxy | H | H | Methylon (βk-MDMA) |
| Ethyl | H | 3,4-Methylenedioxy | H | H | Ethylon (βk-MDEA) |
| Methyl | H | 4-Methyl | Methyl | H | Butylon (βk-MBDB) |
| Methyl | H | 4-Methoxy | H | H | Methedron (βk-PMMA) |
| Methyl | H | 4-F | H | H | Flephedron (4-FMC) |
| Methyl | H | 3-F | H | H | 3-Fluoromethcathinon (3-FMC) |
| {pyrrolidino} | H |
H |
H | α-Pyrrolidinopropiophenon (S.) | |
| {pyrrolidino} | 4-Methyl | H | H | 4-Methyl-α-Pyrrolidinopropiophenon (MS.) | |
| {pyrrolidino} | 4-MeO | H | H | 4-Methoxy-α-Pyrrolidinopropiophenon (MOS.) | |
| {pyrrolidino} | 4-Methyl | Propyl | H | 4-Methyl-α-Pyrrolidino-Hexanophenon (MPHP) | |
| {pyrrolidino} | 4-Methyl | Ethyl | H | Pyrovaleron | |
| {pyrrolidino} | 4-Methyl | Methyl | H | 4-Methyl-α-Pyrrolidino-Butyrophenon (MPBP) | |
| {pyrrolidino} | 4-Methyl | H | Methyl | 4-Methyl-α-Pyrrolidino-α-Methylpropiophenon | |
| {pyrrolidino} | 3,4-Methylenedioxy | H | H | 3,4-Methylenedioxy-α-Pyrrolidinopropiophenon (MDS.) | |
| {pyrrolidino} | 3,4-Methylenedioxy | Ethl | H | 3,4-Methylenedioxypyrovaleron (MDPV) | |
Physische Form
Synthetische Cathinone findet man zumeist als weißes oder braunes amorphes oder kristallines Pulver vor, mitunter verkapselt. Im Gegensatz zu vielen Phenethylamin-Derivaten (MDMA usw.) sind Tabletten weniger verbreitet, werden jedoch gelegentlich auf dem illegalen Markt, vermutlich als Ersatz für MDMA, angeboten.
Pharmakologie
Wie die Phenethylamine wirken die Cathinone ohne Ringsubstitution als Stimulanzien des Zentralnervensystems (ZNS), jedoch ausnahmslos mit einer geringeren Potenz als das jeweils entsprechende Phenethylamin-Analogon. Die niedrigere Potenz ist auf die β-KetogruS. zurückzuführen, durch die ein stärker polares Molekül, das weniger in der Lage ist, die Blut-Hirn-Schranke zu passieren, entsteht. Studien zum Metabolismus von Methcathinon-Derivaten bei Ratten und Menschen haben gezeigt, dass diese Derivate N-demethyliert werden, die KetogruS. zu einer HydroxylgruS. reduziert wird und RingalkylgruS.n oxidiert werden. Ansonsten wurden nur wenige formale Studien zur Pharmakokinetik oder Pharmakodynamik von ringsubstituierten Cathinonen durchgeführt. Beobachtungen an Patienten mit Verdacht auf Mephedron-Vergiftung scheinen nahezulegen, dass Cathinon-Derivate ähnliche sympathomimetische Wirkungen wie Amphetamin-Derivate entfalten. Der erste toxikologisch bestätigte Todesfall, der unmittelbar mit Mephedron im Zusammenhang stand, wurde 2008 in Schweden verzeichnet.
Berichte von Konsumenten im Internet zeigen, dass eine typische Dosis von Mephedron 100–250 mg beträgt. Je nach Substanz sollen die Wirkungen denen von Kokain, Amphetamin oder MDMA. Wie Kokain ist das durch Mephedron ausgelöste „High“ von kurzer Dauer. Deshalb werden möglicherweise oft mehrere Dosen nacheinander, bis zu 1 g während einer Sitzung, konsumiert. Dafür spricht die Beobachtung, dass die häufigste „Briefchengröße“ von Mephedron, die bei Sicherstellungen durch die Polizei im Vereinigten Königreich gefunden wurde, fast 750 g beträgt.
Der Pyrrolidinring und die tertiäre AminogruS. in MDPV könnten zu einem lipophileren, d. h. potenteren Molekül führen. Beiträge in Konsumentenforen online lassen darauf schließen, dass die Dosis nicht mehr als 5–10 mg beträgt. Außerdem sollte beachtet werden, dass p-Methoxyphenethylamines (z. B. PMA, PMMA) für ihre besonders hohe Toxizität bekannt sind und dass diese Eigenschaft sich auf ihre βk-Analoga übertragen könnte. So wurde Methedron (p-Methoxymethcathinon) zum Beispiel bei einigen Todesfällen entdeckt.
Synthese und Vorläufersubstanzen
Einfache Derivate wie zum Beispiel Methcathinon und N,N-Dimethylcathinon können durch Oxidation von Ephedrin (oder Pseudoephedrin) bzw. N-Methylephedrin (oder N-Methylpseudoephedrin) synthetisiert werden. Dies erfordert eine Reaktion der Vorläufersubstanz mit einer Lösung aus Kaliumpermanganat in verdünnter Schwefelsäure. Die Vorläufersubstanzen können als spezifische Enantiomere beschafft werden, wodurch sichergestellt wird, dass die Synthese stereoselektiv ist. Cathinon selbst lässt sich auf ähnliche Weise ausgehend von Phenylpropanolamin (Norephedrin) herstellen. Eine der Gefahren des Permanganatprozesses besteht darin, dass die Konsumenten eine Manganvergiftung erleiden können, wenn das Produkt nicht gereinigt wird.
Die ringsubstituierten N-Methylcathinon-Derivate lassen sich am besten durch Reaktion des geeigneten substituierten Brompropiophenons mit Methylamin synthetisieren; das Ergebnis ist immer racemisch. Im Falle von Methylon kann zum Beispiel 2-Brom-3,4-Methylendioxy-Propiophenon durch Reaktion von 3,4-Methylendioxypropiophenon mit Brom hergestellt werden. Diese Vorläufersubstanzen sind leicht erhältlich, und keine von ihnen steht unter internationaler Kontrolle. Zur Herstellung der Pyrrolidin-Derivate sind andere Methoden erforderlich, doch abgesehen von MDPV wurden Substanzen wie S., MPHP, MOS. und MDS., die im Jahr 2004 in Deutschland kurz auftauchten (siehe Tabelle 1), seither selten beobachtet.
Anwendung
Einige Konsumenten insufflieren (schnupfen) Mephedron, doch die meisten Cathinone werden geschluckt. Da sie wasserlöslich sind, können diese Substanzen auch gespritzt werden. Aufgrund ihrer Instabilität wären die freien Basen wahrscheinlich nicht zum Rauchen geeignet.
Andere Namen
Um mögliche Kontrollen zu umgehen, werden Cathinon-Derivate häufig unter verschiedenen Markennamen (wie z. B. Explosion, Blow, Recharge usw.) als „Pflanzennahrung“, „Badesalz“ oder „Forschungschemikalie“ vermarktet, oftmals mit dem aufgedruckten Warnhinweis, dass sie „nicht für den menschlichen Verzehr“ bestimmt sind. Wie bei den Phenethylaminen werden häufig Akronyme verwendet. So steht MDPV beispielsweise für 3,4-Methylendioxypyrovaleron, 4-FMC für 4-Fluormethcathinon (Flephedron) und 4-MMC für 4-Methylmethcathinon (Mephedron). Einige Straßenbezeichnungen für Mephedron sind M-Cat, Meph, Drone, Miaow, Meow Meow, Subcoca-1 und Bubbles, während Methylon manchmal als Top Cat bezeichnet wird. Diese Substanzen werden jedoch häufig in Produkten mit einer Vielzahl von Markennamen verkauft, die im Laufe der Zeit rasch wechseln, und oft wird der genaue Inhalt dieser Produkte nicht angegeben. Die chemischen Namen können zur Verwirrung führen; Methylon, Mephedron und Methedron sollten sowohl voneinander als auch von dem nicht verwandten narkotischen Analgetikum Methadon unterschieden werden. Die Substanz βk-MBDB wird zwar häufig als „Butylon“ bezeichnet, doch der Name Butylon ist auch als Markenname für das nicht verwandte Barbiturat Pentobarbital verwendet worden.
Analyse
Cathinon-Derivate ergeben im Marquis-Feldtest keine Farbreaktion. Die Analyse mittels GCMS und Infrarot-(IR-)Spektroskopie ist einfach. Für einige Derivate sind zwar keine reinen Referenzproben im Handel erhältlich, doch für die meisten wurden Analysenprofile veröffentlicht. Immunoassay-Feldtests auf Methamphetamin liefern mit einigen Cathinon-Derivaten falsch-positive Ergebnisse.
Kontrollstatus
Diese Informationen entsprechen dem Stand vom 19. Juli 2010.
Cathinon und Methcathinon sind in Liste I des Übereinkommens über psychotrope Substanzen der Vereinten Nationen von 1971 aufgeführt. Amfepramon und Pyrovaleron sind in Liste IV dieses Übereinkommens enthalten, andere Derivate stehen jedoch nicht unter internationaler Kontrolle. Einige Cathinon-Derivate werden in einigen Mitgliedstaaten gemäß dem Drogengesetz oder entsprechenden Rechtsvorschriften kontrolliert, wie zum Beispiel: Mephedron (Belgien, Dänemark, Deutschland, Estland, Irland, Frankreich, Italien, Litauen, Rumänien, Schweden, Kroatien und Norwegen), Methylon (Dänemark, Irland, Rumänien und Schweden), Butylon (Dänemark, Irland, Rumänien, Schweden und Norwegen), MDPV (Dänemark, Irland, Finnland und Schweden) und Flephedron (Dänemark, Irland und Rumänien). Die allgemeine Kontrolle im Vereinigten Königreich umfasst eine breite GruS. von Cathinon-Derivaten. In Finnland und in den Niederlanden wird Mephedron nach dem Arzneimittelgesetz kontrolliert.
Medizinische Anwendung
Amfepramon und Pyrovaleron wurden früher als Anorektika eingesetzt, ihre Anwendung ist jedoch inzwischen weitgehend überholt. Bupropion hat antidepressive Eigenschaften und wird unterstützend zur Raucherentwöhnung eingesetzt.
Publications
Literatur
Advisory Council on the Misuse of Drugs (2010) Consideration of the cathinones, 31 März. Advisory Council on the Misuse of Drugs, Home Office, London. Verfügbar unter: http://www.homeoffice.gov.uk/publications/drugs/acmd1/acmd-cathinodes-r….
Archer, R. (2009) ‘Fluoromethcathinone: A new substance of abuse’, Forensic Science International 185 (1), S. 10–20.
Belal, T., Awad, T., De Ruiter, J. und Clark, C. R. (2009) ‘GC–IRD methods for the identification of isomeric ethoxyphenethylamines and methoxymethcathinones’, Forensic Science International 184, S. 54–63.
Bossong, M. G., Van Dijk, J. P. und Niesink ,R. J. (2005) ‘Methylone and mCS. Two new drugs of abuse?’ Addiction Biology 10 (4), S. 321–323.
Camilleri, A., Johnston, M. R., Brennan, M., Davis, S. und Caldicott, D. G. E. (2010) ‘Chemical analysis of four capsules containing the controlled substance analogues 4-methylmethcathinone, 2-fluoromethamphetamine, alpha-phthalimidopropiophenone and N-ethylcathinone’, Forensic Science International 197 (1–3), S. 59–66.
Carroll, F. Y., Blough, B. E., Mascarella, S. W., et al. (2010) ‘Synthesis and biological evaluation of bupropion analogues as potential pharmacotherapies for smoking cessation’, Journal of Medicinal Chemistry 53 (5), S. 2204–2214.
Chintalova-Dallas, R., Case, P., Kitsenko, N. und Lazzarini, Z. (2009) ‘Boltushka: A homemade amphetamine-type stimulant and HIV risk in Odessa, Ukraine,’ International Journal of Drug Policy 20, S. 347–351.
Cozzi, N. V., Shulgin, A. T. und Ruoho, A. E. (1998) ‘Methcathinone (MCAT) and 2-methylamino-1-(3,4-methylenedioxyphenyl)propan-1-one (MDMCAT) inhibit [3H]serotonin uptake into human platelets’, American Chemical Society Division of Medicine Abstracts 215, S. 152.
Cozzi, N. V., Sievert, M. K., Shulgin, A. T., Jacob III, P. und Ruoho, A. E. (1998) ‘Methcathinone and 2-methylamino-1-(3,4-methylenedioxyphenyl)propan-1-one (methylone) selectively inhibit plasma membrane catecholamine reuptake transporters’, Society for Neuroscience Abstracts 24, S. 381–388.
Cozzi, N. V. Sievert, M. K., Shulgin, A.T., Jacob III, P. und Ruoho, A. E. (1999) ‘Inhibition of plasma membrane monoamine transporters by β-ketoamphetamines’, European Journal of Pharmacology 381, S. 63–69.
Dal Cason, T. A. (1997) ‘The characterization of some 3,4-methylenedioxycathinone (MDCATH) homologs’, Forensic Science International 87, S. 9–53.
Dal Cason, T. A. (2007) ‘Synthesis and identification of N,N-dimethylcathinone hydrochloride’ Microgram Journal 5 (S. 1–4). Verfügbar unter:: http://www.justice.gov/dea/programs/forensicsci/microgram/journal_v5_num14/pg1.html.
Daly, M. (2010) ‘Teenage kicks’, Druglink 25 (1), S. 8–10.
Davies, S., Archer, R. und Ramsey, J. (2009) Analytical profiles of methcathinone and related compounds, London Toxicology Group, London. Verfügbar unter: http://www.ltg.uk.net/admin/files/Methcath.pdf.
Davies, S., Puchnarewicz, M., Button, J., et al. (2009) ‘Two cases of confirmed ingestion of the novel designer compounds: 4-methylmethcathinone (mephedrone) and 3-fluoromethcathinone’, London Toxicology Group poster, London. Verfügbar unter: http://www.ltg.uk.net/admin/files/MethCase(2).pdf.
Dickson, A. J., Vorce, S. P., Levine, B. und Past, M. R. (2010) ‘Multiple-drug toxicity caused by the coadministration of 4-methylmethcathinone (mephedrone) and heroin’, Journal of Analytical Toxicology 34 (3), S. 162–168.
Gibbons, S. und Zloh, M. (2010) ‘An analysis of the “legal high” mephedrone’, Bioorganic & Medicinal Chemistry Letters 20 (14), S. 4135–4139.
Gustavsson, D. und Escher, C. (2009) ‘Mefedron: Internetdrog som tycks ha kommit för att stanna’, Läkartidningen 106 (43), S. 2769–2771. Englische Zusammenfassung verfügbar unter: http://www.lakartidningen.se/07engine.php?articleId=12986.
Kamata, H. T., Shima, N., Zaitsu, K. et al. (2006) ‘Metabolism of the recently encountered designer drug, methylone, in humans and rats’, Xenobiotica 36 (8), S. 709–723.
Measham, F., Moore, K., Newcombe, R. und Welch, Z. (2010) ‘Tweaking, bombing, dabbing and stockpiling: The emergence of mephedrone and the perversity of prohibition’, Drugs and Alcohol Today, 2010, 10 (S. 14-21).
Meltzer, P. C., Butler, D., Deschamps, J. R. und Madras, B. K. (2006) ‘1-(4-Methylphenyl)-2-pyrrolidin-1-yl-pentan-1-one (pyrovalerone) analogues: A promising class of monoamine uptake inhibitors’, Journal of Medicinal Chemistry 49, S. 1420–1432.
Meyer, M. R., Peters, F. T. und Maurer, H. H. (2009) ‘Metabolism of the new designer drug mephedrone and toxicological detection of the beta keto designer drugs mephedrone, butylone and methylone in urine’, Annales de Toxicologie Analytique 21.
Meyer, M. R., Wilhelm, J., Peters, F. T. und Maurer, H. H. (2010) ‘Beta-keto amphetamines: Studies on the metabolism of the designer drug mephedrone and toxicological detection of mephedrone, butylone, and methylone in urine using gas chromatography–mass spectrometry’, Analytical and Bioanalytical Chemistry 397 (3), S. 1225–1233.
Nagai, F., Nonaka, R. und Kamimura, K. S. H. (2007) ‘The effects of non-medically used psychoactive drugs on monoamine neurotransmission in rat brain’, European Journal of Pharmacology 559 (2–3), S. 132–137.
Naoya, A., Kiyoshi, W. und Masahiko, F. (2006) ‘Role of dopaminergic system in the expression of methylone-induced behavioral effect in mice’. Bulletin of the Japanese Society for Neurochemistry 45(2–3), S. 301.
Power, M. (2010) ‘Mephedrone: The future of drug dealing?’, Druglink March/April 2010, Volume 25(1), S. 7–13.
Power, M. (2010) ‘World wired web’, Druglink 25 (1), S. 11–13.
Roussel, O., Perrin, M., Herard, P., Chevance, M. and Arpino, P. (2009) ‘La 4-méthyléphédrone sera-t-elle une “Ecstasy” du XXIème siècle?’, Annales de Toxicologie Analytique 21 (4), S. 169–177.
Shima, N., Katagi, M. und Tsuchihashi, H. (2009) ‘Direct analysis of conjugate metabolites of methamphetamine, 3,4-methylenedioxymethamphetamine, and their designer drugs in biological fluids’, Journal of Health Science 55 (4), S. 495–502.
Shimizu, E., Watanabe, H., Kojima, T. et al. (2007) ‘Combined intoxication with methylone and 5-MeO-MIPT’, Progress in Neuro-Psychopharmacology and Biological Psychiatry 31 (1), S. 288–291.
Springer, D., Fritschi, G. und Maurer, H. H. (2003) ‘Metabolism of the new designer drug α-pyrrolidinopropiophenone (S.) and the toxicological detection of S. and 4'-methyl-α-pyrrolidinopropiophenone (MS.) studied in rat urine using gas chromatography-mass spectrometry’, Journal of chromatography. Analytical technologies in the biomedical and life sciences 796 (2), S. 53–66.
Springer, D., Fritschi, G. und Maurer, H. H. (2003) ‘Metabolism and toxicological detection of the new designer drug 3',4'-methylenedioxy-α-pyrrolidinopropiophenone studied in urine using gas chromatography-mass spectrometry’, Journal of chromatography. Analytical technologies in the biomedical and life sciences 793 (2), S. 377–388.
Springer, D., Fritschi, G. und Maurer, H. H. (2003) ‘Metabolism and toxicological detection of the new designer drug 4'-methoxy-α-pyrrolidinopropiophenone studied in rat urine using gas chromatography-mass spectrometry’, Journal of chromatography. Analytical technologies in the biomedical and life sciences 793 (2), S. 331–342.
Springer, D., Peters, F.T., Fritschi, G. und Maurer, H. H. (2003) ‘New designer drug 4′-methyl-α-pyrrolidinohexanophenone: Studies on its metabolism and toxicological detection in urine using gas chromatography–mass spectrometry’, Journal of chromatography. Analytical technologies in the biomedical and life sciences 789 (1), S. 79–91.
Springer, D., Staack, R. F., Paul, L. D., Kraemer, T. und Maurer, H. H. (2003) ‘Identification of cytochrome P450 enzymes involved in the metabolism of 4-methoxy-a-pyrrolidinopropiophenone (MOS.), a designer drug, in human liver microsomes’, Xenobiotica 33 (10), S. 989–998.
Staack, R.F, .Fritschi, G. und Maurer, H. H. (2002) ‘Studies on the metabolism and toxicological detection of the new designer drug 4'-methyl-a-pyrrolidinopropiophenone in urine using gas chromatography-mass spectrometry’, Journal of chromatography. Analytical technologies in the biomedical and life sciences773 (1), S. 25–33.
Sumnall, H. und Wooding, O. (2010) Mephedrone: An update on current knowledge, North West Public Health Laboratory, Liverpool John Moores University. Verfügbar unter: http://www.cph.org.uk/showPublication.aspx?pubid=614.
Szendrei, K. (1980) ‘The chemistry of khat’, Bulletin on Narcotics 32 (3), S. 5–35.
Uchiyama, N., Kikura-Hanajiri, R., Kawahara, N., und Goda, Y. (2008) ‘Analysis of designer drugs detected in the products purchased in fiscal year 2006’, Journal of the Pharmaceutical Society of Japan 128 (10), S. 1499–1506.
Westphal, F., Junge, T., Rösner, P., et al. (2006) ‘Mass spectral and NMR spectral data of two new designer drugs with an α-aminophenone structure: 4′-methyl-α-pyrrolidinohexanophenone and 4′-methyl-α-pyrrolidinobutyrophenone’, Forensic Science International 169 (1), S. 32–42.
Westphal, F., Junge, T., Rösner, P., Sönnichsen, F. und Schuster, F. (2009) ‘Mass and NMR spectroscopic characterization of 3,4-methylenedioxypyrovalerone: A designer drug with α-pyrrolidinophenone structure’, Forensic Science International 190 (1), S. 1–3.
Winstock, A. (2010) ‘Drugs survey’, Mixmag 14 January.
Winstock, A. R., Marsden, J. and Mitcheson, L. (2010) ‘What should be done about mephedrone?’, BMJ 340, S. c1605.
Wood, D., Davies, S., Puchnarewicz, M., et al. (2010) ‘Recreational use of mephedrone (4-methylmethcathinone, 4-MMC) with associated sympathomimetic toxicity’, Journal of Medical Toxicology, 1 April.
Wood, D. M., Davies, S., Puchnarewicz, M., et al. (2009) ‘Recreational use of 4-methylmethcathinone (4-MMC) presenting with sympathomimetic toxicity and confirmed by toxicological screening. Abstracts of the 2009 North American Congress of Clinical Toxicology Annual Meeting, September 21–26, 2009, San Antonio, Texas, USA’, Clinical Toxicology 47 (7), S. 733.
World Health Organization (2006) Assessment of khat (Catha edulis Forsk), 34th Meeting, Expert Committee on Drug Dependence. Verfügbar unter: http://www.who.int/medicines/areas/quality_safety/4.4KhatCritReview.pdf.
Zaitsu, K., Katagi, M., Kamata, H., et al. (2009) ‘Determination of the metabolites of the new designer drugs bk-MBDB and bk-MDEA in human urine’, Forensic Science International 188 (1–3), S. 131–139.
Zaitsu, K., Katagi, M., Kamata, H. T., Miki, A. und Tsuchihashi, H. (2008) ‘Discrimination and identification of regioisomeric β-keto analogues of 3,4-methylenedioxy-amphetamines by gas chromatography-mass spectrometry’, Forensic Toxicology 26 (2), S. 45–51.











